Phản ứng tạo hoạt chất khử trùng
Hypochlorite khi hòa tan trong nước sẽ phân ly thành ion OCl- theo phương trình sau:
Ca(OCl)2 -> Ca2+ + 2OCl-
NaOCl -> Na+ + OCl-
Trong môi trường có pH thấp ion OCl- sẽ kết hợp với ion H+ để hình thành HOCl theo phản ứng:
OCl- + H+ -> HOCl
Cả hai HOCl (E0=1,49V) và OCl- (E0=0,89V) đều là chất ôxy hóa mạnh, chúng có thể phản ứng với một số phân tử chất sống như protein, peptid, amino acid, lipid, ADN trong điều kiện pH sinh lý.
Đối với nhóm Chloramine khi hòa tan trong nước cũng bị phân ly thành ion R-NCl-, trong môi trường pH thấp R-NCl- phản ứng với H+ qua một chuổi phản ứng để hình thành HOCl (Diwya et al., 2012).
R-NClNa -> R-NCl- + Na+
(R= C6H5SO2 hay C7H7SO2)
R-NCl- + H+ -> R-NHCl
2R-NHCl -> R-NH2+ R-NCl2
R-NHCl + H2O -> R-NH2 + HOCl
R-NCl2 + H2O -> R-NHCl + HOCl
Đối với Trichlorocyanuric acid khi hòa tan vào trong nước chúng phản ứng với nước để hình thành cyanuric acid và HOCl (Chuenarrom et al., 2014), phương trình phản ứng như sau:
C3Cl3N3O3 + 3H2O -> C3H2N3O3 + 3HOCl
Như vậy, hoạt chất khử trùng của Chloramine và Trichlorocyanuric acid hoàn toàn giống với Hypochlorite.
Cơ chế khử trùng
Các chất khử trùng có chứa nguyên tố Chlorine có phổ diệt vi sinh rộng. Khả năng khử trùng của các chất này khi hòa tan trong nước phụ thuộc vào hàm lượng của HOCl chứ không phụ thuộc vào tổng hàm lượng Chlorine (total available chlorine). Điều này được giải thích là do HOCl dễ dàng xâm nhập qua vách và màng để đi vào bên trong tế bào vi sinh vật.
Nguyên tử Clrorine trong phân tử HOCl hay ion OCl- tích điện dương (Cl+) nên ái lực điện tử rất mạnh, Cl+ có thể kết hợp với các đôi điện tử của các chất có mật độ điện tử cao (Wojtowicz, 1979). Một số phân tử chất sống chứa liên kết carbon nối đôi (-C=C-), liên kết peptid, nhóm amine (-NH2) và nhóm thiol (R-SH hay -C-SH) rất nhạy với ái lực điện tử của Cl+, kết quả Cl+ thu nhận 2e- và bị khử thành Cl-, các phân tử chất sống bị thay đổi cấu trúc và mất hoạt tính sinh học (Fukuzaki, 2006). Các phân tử chất sống có khả năng phản ứng nhanh với HOCl và OCl- bao gồm: Porphyrin và heme (tiểu phần tử cấu trúc nên hemoglobin), ferredoxin (phần tử vận chuyển điện tử), purine và pyrimidine (tiểu phần từ cấu trúc nên ADN), chất sắc tố (conjugated polyene), amino acid... (Albrich et al., 1981)
Cơ chế khử trùng của HOCl hay OCl- là ức chế các enzyme cần thiết cho hoạt động sinh trưởng, gây tổn thương màng tế bào và ADN. HOCl tác động làm sinh ra một số chất oxy hóa độc hại gây tổn thương cho các thành phần trong tế bào.
Tác dụng khử trùng của HOCl và OCl- dựa trên khả năng xâm nhập của chúng vào bên trong tế bào vi sinh vật. Ion OCl- thì không thể xâm nhập qua màng tế bào của vi sinh vật do sự tồn tại của lớp kỵ nước (hydrophobic layer) thuộc màng lipid kép. Một số trường hợp, vách tế bào vi sinh vật cấu trúc đặc biệt có khả năng bảo vệ tế bào chống sự xâm nhập của OCl-. Mycobateria và Corynebacteria có cấu trúc vách tế bào đặc biệt, peptidoglycan liên kết đồng hóa trị (covalency) với mycolic acid chứa một acid béo có mạch dài đến 90 nguyên tử carbon. Mycolic acid có rào chắn kỵ nước (hydrophobic barrier) ngăn sự xâm nhập của OCl-. Vì vậy, OCl- chỉ oxy hóa lớp bên ngoài của tế bào như phá vỡ vách và làm mất chức năng của protein của màng tế bào. Điều này giải thích tại sao OCl có tác dụng khử trùng rất yếu. Ngược lại, HOCl có thể xâm nhập qua lớp lipid kép của màng tế bào bằng cách khuếch tán thụ động do HOCl không tích điện và phân tử có kích thước nhỏ so với nước. Vì vậy, HOCl không chỉ công phá bên ngoài mà còn cả bên trong tế bào nên khả năng khử trùng của HOCl rất cao (Hình 2).
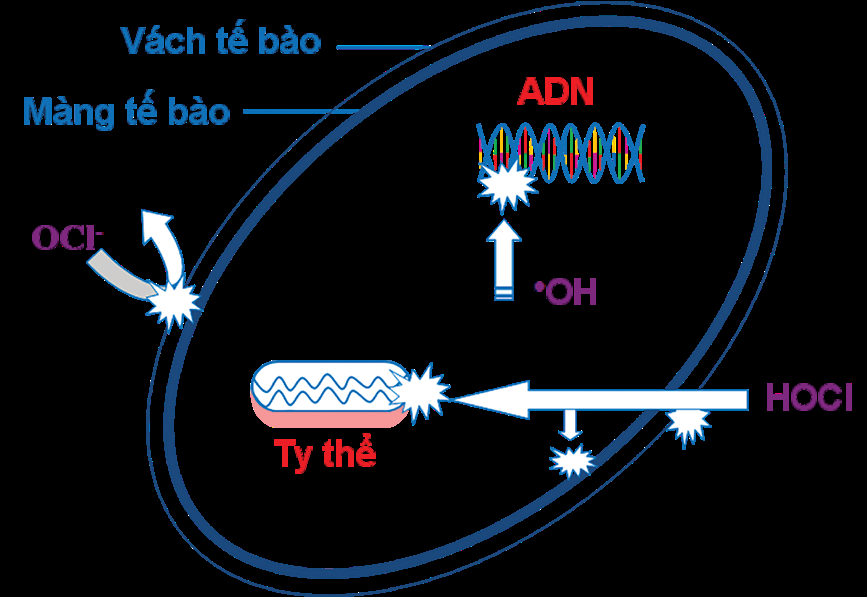
Tác động của HOCl làm mất chức năng xúc tác của enzyme sulhydryl và giảm các chất chống ôxy hóa (antioxidant) như glutathione sẽ gây hại đến vi khuẩn (Albrich et al., 1981). HOCl cũng phá vỡ quá trình phosphoryl hóa - ôxy hóa (quá trình oxy hóa vật chất dinh dưỡng giải phóng năng lượng từ đó tổng hợp ATP) (Barrette et al., 1989). HOCl cũng gián tiếp gây tổn hại đến ADN của vi sinh vật.
Tác động của HOCl có liên quan đến các gốc hoạt động chứa ôxy ( Reactive Oxygen Species - ROS) sinh ra bên trong tế bào vi sinh vật (Dukan, et al., 1999). Sinh vật hiếu khí phải đối phó với các gốc hoạt động chứa ôxy như ion superoxide (•O2 -), hydrogen peroxide (H2O2) và hydroxyl radical (HO•) hình thành từ sự khử của ôxy trong quá trình phosphoryl hóa - ôxy hóa (oxidative phosphorylation):
O2 -> O2 --> H2O2 -> HO• -> H2O
Quá trình phosphoryl hóa - ôxy hóa xảy ra ở màng trong của ty thể (mitochondrial inner membrane) của tế bào nhân chuẩn (eukaryotic cell) và màng tế bào của tế bào nhân sơ (prokaryotic cell). Tế bào có hệ thống phòng thủ (bảo vệ tế bào) bao gồm các chất chống ôxy hóa (glutathione) và các enzyme xúc tác (peroxidase, peroxide dismutase), khi các chất chống ôxy hóa bị cạn kiệt hoặc các enzyme bị vô hiệu hóa bởi HOCl thì O2 -và H2O2 sẽ bị tích tụ. Khi đó, H2O2 sẽ khuếch tán vào tế bào chất, chúng sẽ phản ứng với sắt tự do (Fe2+) sinh ra từ heme hay Feprotein dưới tác động của HOCl tạo ra gốc tự do HO• (hydroxyl radical). Hơn nữa, HOCl phản ứng với Fe2+ và cũng tạo ra HO• (Folkes et al., 1995), phương trình phản ứng như sau:
H2O2 + Fe2+ -> HO•+ OH- + Fe3+
HOCl + Fe2+ -> HO• + Cl- + Fe3+
Vì vậy, gốc tự do nội sinh dưới tác động của HOCl có khả năng ôxy hóa rất mạnh (E0=2,86V), chúng tấn công ADN là gia tăng khả năng bất hoạt vi sinh vật.
Những điều cần lưu ý khi khử trùng nước bằng Chlorine
Chlorine tự do (Cl2, HOCl, và OCl-) tồn lưu trong nước sẽ gây độc đối với tôm cá và các loài thủy sinh vật. Nồng độ Chlorine tự do tối đa cho phép đối với thủy sinh vật là 0,01 mg/L. Ở nồng độ 0,1 mg/L, Chlorine tự do có thể gây chết hầu hết phiêu sinh vật biển và nồng độ Chlorine tự do 0,37 mg/L có thể gây chết cá. Do đó, sau khi khử trùng nên khử Chlorine hoặc sục khí mạnh trong 3 - 5 ngày trong điều kiện có ánh sáng trước khi thả cá. Có thể khử Chlorine sau khi khử trùng bằng Na2S2O3, để loại bỏ 1 mg/L Cl cần dùng 6,99 mg/L Na2S2O3
Cl2 + 2Na2S2O3·5H2O → Na2S4O6 + 2NaCl + 10H2O
Trong môi trường giàu muối dinh dưỡng, HOCl phản ứng với NH3 hình thành các hợp chất Chloramine vô cơ (NH2Cl, NHCl2 hoặc NCl3), các hợp chất này bền, có thời gian lưu tồn lâu và cũng độc đối với sinh vật. Các hợp chất Chloramine có tác dụng giống như NO2 -, chúng phản ứng với Hemoglobine tạo thành Methemoglobine gây ra chứng bệnh máu màu nâu và làm giảm khả năng vận chuyển ôxy của máu (cá bị nổi đầu). Do đó, không nên dùng Chlorine để diệt tảo và diệt khuẩn cho ao nuôi, Chlorine sẽ làm giảm sinh trưởng và tỷ lệ sống của cá.
Trong môi trường giàu xác hữu cơ, HOCl sẽ phản ứng với CH4 và các ion halogen có trong nước để hình thành các hợp chất Trihalomethan (CHCl3, CHCl2Br, CHClBr2…). Trihalomethan (THMs) là các hợp chất độc với thủy sinh vật và con người, chúng được xem là tác nhân gây bệnh ung thư ở người và động vật. Trihalomethan rất bền, chúng có thể tích tụ trong cơ thể động vật và truyền từ sinh vật này sang sinh vật khác trong chuỗi dinh dưỡng. Giới hạn của EPA (Mỹ) về hàm lượng THMs trong nguồn nước sau xử lý Chlorine phải nhỏ hơn 80μg/L.
PGS.TS TRƯƠNG QUỐC PHÚ Trường Thủy sản, Trường Đại học Cần Thơ

